《多伴侣蛋白凝聚物增强内质网中的蛋白质折叠》这篇发表在《自然・细胞生物学》( Cell )上的文章,聚焦内质网中蛋白质折叠这一关键细胞过程,为我们深入理解细胞内蛋白质稳态调控提供了新视角。

蛋白质折叠是细胞生命活动的核心环节之一。在真核细胞中,内质网是负责分泌蛋白和膜蛋白折叠、组装与质量控制的重要场所。细胞内的蛋白质要发挥正常功能,必须折叠成特定的三维结构。然而,蛋白质折叠过程容易受到多种因素干扰,若折叠错误,可能形成毒性聚集体,引发多种疾病,如神经退行性疾病等。因此,内质网中蛋白质折叠的高效与精准调控至关重要。
分子伴侣是一类在细胞内协助其他蛋白质正确折叠、组装、转运和降解的蛋白质,它们在蛋白质折叠过程中扮演着关键角色。以往研究表明,多种分子伴侣协同作用,保障内质网中蛋白质折叠的顺利进行。但这些分子伴侣如何在空间和时间上有序组织,形成高效的蛋白质折叠调控网络,仍有诸多未知。
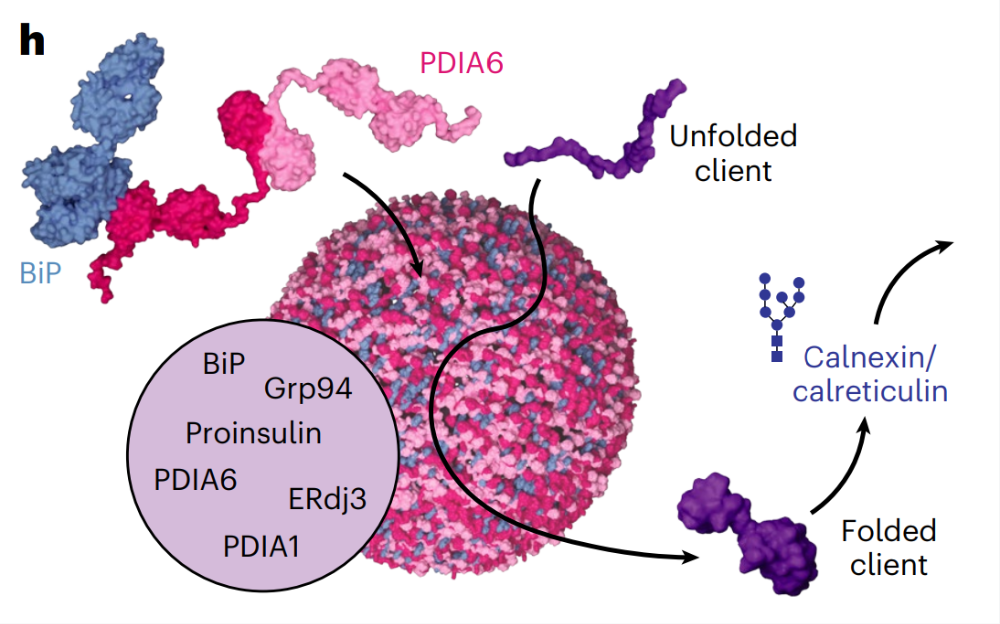
这篇文章提出了 “多伴侣蛋白凝聚物” 的概念,揭示了内质网中多种分子伴侣会形成凝聚物()结构。这种凝聚物并非简单的分子伴侣混合体,而是通过相分离等机制形成的具有特定空间组织的动态结构。研究发现,多伴侣蛋白凝聚物能够将需要折叠的蛋白质招募到其中,为蛋白质折叠提供了一个相对集中且优化的微环境。在这个微环境中,不同分子伴侣可以协同作用,更高效地促进蛋白质正确折叠,同时减少错误折叠和聚集体的形成。
从机制层面来看,多伴侣蛋白凝聚物的形成涉及到分子伴侣之间的相互作用以及它们与底物蛋白质的相互作用。相分离过程使得分子伴侣在局部高浓度聚集,增加了它们与底物蛋白质的碰撞频率和作用效率。此外,凝聚物的动态特性也保证了其可以根据细胞内蛋白质折叠的需求进行调整,比如在蛋白质折叠负荷增加时,凝聚物可能会发生结构或组成的变化,以增强折叠能力。
这一发现丰富了我们对细胞内蛋白质折叠调控机制的认识,让我们了解到除了传统的分子伴侣线性作用模式外,通过形成凝聚物的空间组织方式,也能高效调控蛋白质折叠。这为研究其他细胞区室中蛋白质折叠调控提供了新的思路,可能在其他细胞器中也存在类似的基于凝聚物的蛋白质折叠调控机制。
如果能深入理解多伴侣蛋白凝聚物在蛋白质折叠中的作用机制,就有可能针对这些凝聚物开发出相关药物或干预手段。例如,在神经退行性疾病中,促进细胞内有益的多伴侣蛋白凝聚物形成,或者修复异常的凝聚物功能,可能有助于缓解蛋白质错误折叠引发的病理过程。此外,在生物技术领域,如蛋白质的体外合成与折叠,借鉴多伴侣蛋白凝聚物的作用机制,有望开发出更高效的蛋白质折叠策略,提高重组蛋白质的产量和活性。
原文链接:
相关文章




